常温下,0.1mol/L的酸HA溶液的pH>1,0.1mol/L的碱BOH溶液中c(OH-)与c(H+)之比为1012,
来源:学生作业帮 编辑:百度作业网作业帮 分类:化学作业 时间:2024/04/28 10:39:56
常温下,0.1mol/L的酸HA溶液的pH>1,0.1mol/L的碱BOH溶液中c(OH-)与c(H+)之比为1012,将两溶液等体积混合,以下判断正确的是( )
A. HA是一种强酸
B. 反应后溶液中c(OH-)<c(H+)
C. 反应后混合液呈中性
D. 反应后混合液中还含有HA分子
A. HA是一种强酸
B. 反应后溶液中c(OH-)<c(H+)
C. 反应后混合液呈中性
D. 反应后混合液中还含有HA分子
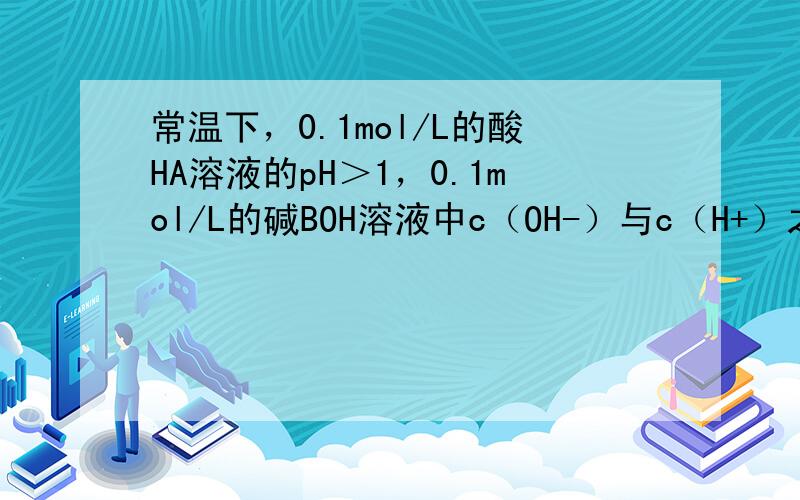
常温下,0.1mol/L的酸HA溶液的pH>1,说明HA不完全电离为弱电解质,0.1mol/L的碱BOH溶液中c(OH-)/c(H+)=1012,c(OH-).c(H+)=10-14,则c(OH-)=0.1mol/L,则BOH完全电离为强碱,将两溶液等体积混合,二者恰好反应生成强碱弱酸盐,溶液溶液呈碱性,
A.常温下,0.1mol/L的酸HA溶液的pH>1,说明HA不完全电离为弱电解质,所以HA为弱酸,故A错误;
B.二者恰好反应生成强碱弱酸盐,弱酸根离子水解而使其溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.二者恰好反应生成强碱弱酸盐,弱酸根离子水解而使其溶液呈碱性,故C错误;
D.二者恰好反应生成强碱弱酸盐,弱酸根离子水解生成HA,所以溶液中还存在HA分子,故D正确;
故选D.
A.常温下,0.1mol/L的酸HA溶液的pH>1,说明HA不完全电离为弱电解质,所以HA为弱酸,故A错误;
B.二者恰好反应生成强碱弱酸盐,弱酸根离子水解而使其溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.二者恰好反应生成强碱弱酸盐,弱酸根离子水解而使其溶液呈碱性,故C错误;
D.二者恰好反应生成强碱弱酸盐,弱酸根离子水解生成HA,所以溶液中还存在HA分子,故D正确;
故选D.
常温下,0.1mol/L的酸HA溶液的pH>1,0.1mol/L的碱BOH溶液中c(OH-)与c(H+)之比为1012,
常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,
常温时0.1mol•L-1HA溶液的pH>1,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,将两溶
常温下,0.1mol/L的一元酸HA溶液的pH=2.0,0.1mol/L的一元碱BOH的溶液中[OH-]/[H】
常温下,已知0.1mol//的一元酸HA溶液,pH>1,0.1mol/l的一元酸BOH溶液中
常温下,0.1mol/L某一元酸(HA)溶液中c(OH−)c(H+)=1×10-8,下列叙述正确的是( )
常温下,0.1mol/L一元酸HA溶液中c(OH-)/c(H+)=1*10的负8次方
常温下,0.1mol•L-1某一元酸HA溶液中c(OH−)c(H+)=1×10-8.下列叙述正确的是( )
常温下,0.1mol/L某一元酸(HA)溶液中 c(OH-)/c(H+)=1×10-8,下列叙述正确的是
常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10的负8次方,该一元酸溶液的PH=1 为什
常温下,0.1mol/L的Hcl溶液中,c(H+)=?,pH=?,0.05mol/L的Ba(OH)2溶液中,c(OH-)
25°时,0.1mol/l的HA溶液中c H+/c OH-=10∧10,0.1mol/l的BOH溶